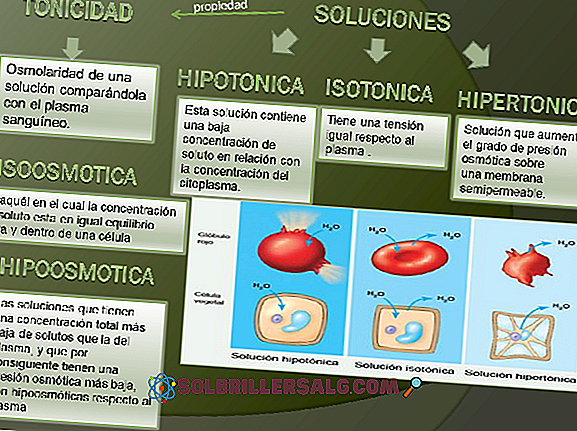
Derivați halogenați: nomenclatură, proprietăți, utilizări și exemple
Derivații halogenați sunt acei compuși care posedă un atom de halogen; adică, oricare dintre elementele grupului 17 (F, CI, Br, I). Aceste elemente diferă de restul deoarece sunt mai electonegative, formând o varietate de halogenuri anorganice și organice.
Moleculele gazoase ale halogenurilor sunt prezentate în imaginea de jos. De sus în jos: fluor (F 2 ), clor (Cl 2 ), brom (Br 2 ) și iod (I 2 ). Fiecare dintre acestea are capacitatea de a reacționa cu marea majoritate a elementelor, chiar și printre congenerii aceluiași grup (interhalogen).

Astfel, derivații halogenați au formula MX dacă este o halogenură metalică, RX dacă este alchil și ArX dacă este aromatică. Ultimele două sunt în categoria halogenurilor organice. Stabilitatea acestor compuși necesită un "avantaj" al energiei împotriva moleculei gazoase inițiale.
De regulă, fluorul formează derivați halogenați mai stabili decât iodul. Motivul se datorează diferențelor dintre razele lor atomice (sferele violet sunt mai voluminoase decât cele galbene).
Atunci când crește raza atomică, suprapunerea orbitalilor între halogen și celălalt atom este mai săracă și, prin urmare, legătura este mai slabă.
nomenclatură
Modul de a desemna corect aceste compuși depinde de faptul că acestea sunt anorganice sau organice.
anorganicele
Halogenurile metalice constau dintr-o legătură, ionică sau covalentă, între un halogen X și un metal M (din grupele 1 și 2, metale tranziționale, metale grele etc.).
În acești compuși toți halogeni au o stare de oxidare de -1. De ce? Deoarece configurațiile sale de valență sunt ns2np5.
De aceea, ei trebuie să obțină un singur electron pentru a completa octetul de valență, în timp ce metalele sunt oxidate, dându-le electronii pe care îi au.
Astfel, fluorul rămâne ca F-, fluorură; Cl-, clorură; Br-, bromură; și I-, iodură. MF ar fi numit: fluorura de (numele metalului) (n), n fiind valența metalului numai atunci când are mai mult de unul. În cazul metalelor din grupele 1 și 2, nu este necesară denumirea valenței.
Exemple
- NaF: fluorură de sodiu.
- CaCI2: clorură de calciu.
- AgBr: bromură de argint.
- ZnI2: iodură de zinc.
- CuCI: clorură de cupru (I).
- CuCI2: clorură de cupru (II).
- TiCl4: clorură de titan (IV) sau tetraclorură de titan.
Cu toate acestea, elementele hidrogen și nemetalice - chiar și halogenurile - pot, de asemenea, să formeze halogenuri. În aceste cazuri, valența nemetalică nu este numită la sfârșit:
- PCI 5 : pentaclorură de fosfor.
- BF3: trifluorură de bor.
- AlI3: triiodură de aluminiu.
- HBr: bromhidrat.
- IF 7 : heptafluorură de iod.
organic
Indiferent dacă este RX sau ArX, halogenul este legat covalent la un atom de carbon. În aceste cazuri, halogeni sunt menționați prin numele lor, iar restul nomenclatorului depinde de structura moleculară a lui R sau Ar.
Pentru cea mai simplă moleculă organică, metanul (CH4), următorii derivați sunt obținuți prin substituirea cu H pentru Cl:
- CH3CI: Clorometan.
- CH2CI2: diclormetan.
- CHCI3: triclormetan (cloroform).
- CCl4: tetraclormetan (clorură de carbon (IV) sau tetraclorură de carbon).
Aici R constă dintr-un singur atom de carbon. Apoi, pentru alte lanțuri alifatice (liniare sau ramificate) numărul de atomi de carbon de la care este legat la halogen se numără:
CH3CH2CH2F: 1-fluorpropan.
Exemplul anterior a fost acela al unei halogenuri de alchil primare. În cazul în care lanțul este ramificat, cel mai lung lanț care conține halogenul este ales și începe să conteze, lăsându-l cât mai puțin posibil:

3-metil-5-bromhexan
În același mod se întâmplă și pentru alți substituenți. De asemenea, pentru halogenurile aromatice se numește halogenul și apoi restul structurii:

În imaginea superioară este prezentat compusul numit brombenzen, evidențiind atomul de brom în maro.
proprietăţi
Halogenuri anorganice
Halogenurile anorganice sunt solide ionice sau moleculare, deși cele mai vechi sunt mai abundente. În funcție de interacțiunile și razele ionice ale MX, acesta va fi solubil în apă sau în alți solvenți mai puțin polari.
Halidele nemetalice (cum ar fi borul) sunt, de obicei, acizi Lewis, ceea ce înseamnă că acceptă electroni pentru a forma complexe. Pe de altă parte, halogenurile (sau halogenurile) de hidrogen dizolvate în apă produc ceea ce se numește hidrazide.
Punctele sale de topire, fierbere sau sublimare intră pe interacțiunile electrostatice sau covalente dintre metal sau nemetal cu halogen.
De asemenea, radiatoarele ionice joacă un rol important în aceste proprietăți. De exemplu, dacă M + și X - au dimensiuni similare, cristalele lor vor fi mai stabile.
Halogenuri organice
Sunt polari. De ce? Deoarece diferența dintre electronegativitățile dintre C și halogen creează un moment polar permanent în moleculă. De asemenea, aceasta scade, pe măsură ce grupa 17 coboară, de la legătura C-F la C-I.
Fără a lua în considerare structura moleculară a lui R sau Ar, numărul crescând de halogeni afectează în mod direct punctele de fierbere, deoarece ele măresc masa molară și interacțiunile intermoleculare (RC-X-X-CR). Cele mai multe sunt nemiscibile cu apa, dar se pot dizolva in solventi organici.
aplicații
Utilizările derivatelor halogenate ar putea să-și rezerve propriul text. Partenerii moleculari ai halogentelor sunt un factor-cheie, dat fiind că proprietățile și reactivitățile lor definesc utilizările derivatului.
Astfel, printre marea diversitate a posibilelor utilizări, se remarcă următoarele:
- halogenurile moleculare sunt folosite pentru a crea becuri cu halogen, unde sunt plasate în contact cu filamentul incandescent de tungsten. Scopul acestui amestec este de a reacționa halogenul X cu tungstenul evaporat. Acest lucru previne depunerea pe suprafața bulbului, garantând o durată mai lungă de viață.
- sărurile fluorurilor sunt utilizate în fluorizarea apei și a pastelor de dinți.
- Hipocloritul de sodiu și de calciu sunt doi agenți activi în soluțiile comerciale de albire (clor).
- Deși deterioră stratul de ozon, în aerosoli și sisteme de răcire se utilizează clorofluorocarburi (CFC).
- Clorura de vinil (CH2 = CHCl) este monomerul polimerului de clorură de polivinil (PVC). Pe de altă parte, Teflon, folosit ca material antiaderent, constă din lanțuri de polimeri tetrafluoretilenici (F 2 C = CF 2 ).
- Sunt utilizate în chimia analitică și în sinteza organică pentru diferite scopuri; printre acestea, sinteza drogurilor.
Exemple suplimentare

Imaginea superioară ilustrează hormonul tiroidian, responsabil pentru producerea căldurii, precum și creșterea metabolismului general în organism. Acest compus este un exemplu de derivat halogenat prezent în corpul uman.
Printre alți compuși halogenați sunt menționați:
- Diclorodifeniltricloretano (DDT), un insecticid eficient, dar cu efecte grave asupra mediului.
- Clorura de staniu (SnCl2), utilizată ca agent reducător.
- Cloroetan sau 1-cloretan (CH3CH2Cl), un anestezic local care acționează rapid prin răcirea pielii.
- Diclo-etilenă (ClCH = CClH) și tetrachloretilenă (Cl2C = CCI2), utilizată ca solvenți în industria de curățare uscată.