Cei 6 factori care afectează solubilitatea principală
Principalii factori care afectează solubilitatea sunt polaritatea, efectul ionului comun, temperatura, presiunea, natura solutului și factorii mecanici.

Solubilitatea unei substanțe depinde în principal de solventul utilizat, precum și de temperatură și presiune. Solubilitatea unei substanțe într-un anumit solvent este măsurată prin concentrația soluției saturate.
O soluție este considerată saturată atunci când adăugarea de solutar suplimentar nu mărește concentrația soluției.
Gradul de solubilitate variază în funcție de substanțe, de la infinit solubil (complet miscibil), cum ar fi etanolul în apă, până la solubil puțin, cum ar fi clorura de argint în apă. Termenul "insolubil" este adesea aplicat compușilor slab solubili (Boundless, SF).
Anumite substanțe sunt solubile în toate proporțiile cu un solvent dat, cum ar fi etanolul în apă, această proprietate este cunoscută ca miscibilitate.
În condiții diferite, solubilitatea în echilibru poate fi depășită pentru a da o soluție numită suprasaturată (Solubilitate, SF).
Principalii factori care afectează solubilitatea
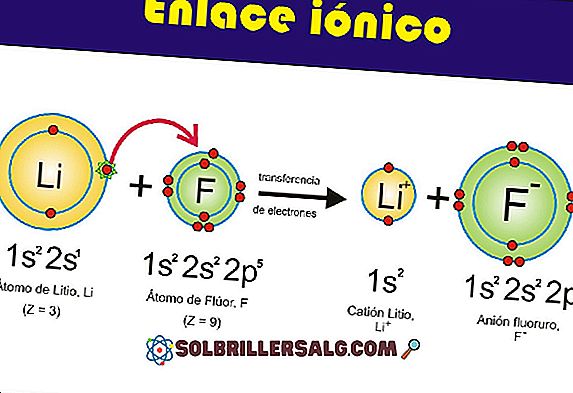
1- Polaritate
În cele mai multe cazuri, substanțele dizolvate se dizolvă în solvenți care au o polaritate similară. Chimistii folosesc un aforism popular pentru a descrie aceasta caracteristica a substantelor dizolvate si a solventilor: "se dizolva asemanator".
Soluiții non-polari nu se dizolvă în solvenți polari și invers (Educating online, SF).
2- Efectul ionului comun
Efectul ionic comun este un termen care descrie scăderea solubilității unui compus ionic atunci când o sare care conține un ion care există deja în echilibrul chimic este adăugată amestecului.
Acest efect este cel mai bine explicat prin principiul lui Le Châtelier. Imaginați-vă dacă sulfatul de calciu ionic slab dizolvat, CaSO4, este adăugat în apă. Ecuația ionică netă pentru echilibrul chimic rezultat este după cum urmează:
CaSO4 (s) ⇌Ca2 + (aq) + SO42- (aq)
Sulfatul de calciu este puțin solubil. În echilibru, cea mai mare parte a calciului și sulfatului există în formă solidă de sulfat de calciu.
Să presupunem că compusul ionic solubil sulfat de cupru (CuS04) a fost adăugat la soluție. Sulfatul de cupru este solubil; Prin urmare, singurul său efect important în ecuația net ionică este adăugarea de ioni de sulfat mai mulți (SO4-2).
CuSO4 (s) ⇌Cu2 + (aq) + SO42- (aq)
S-au disociat ionii de sulfat de cupru sulfat de cupru (obișnuiți) în amestec din ușoară disociere a sulfatului de calciu.
Prin urmare, această adăugare de ioni de sulfat evidențiază echilibrul stabilit anterior.
Principiul Le Chatelier dictează că efortul suplimentar pe această parte a produsului de echilibru are ca rezultat schimbarea echilibrului față de partea reactanților pentru a atenua această nouă tensiune.
Datorită schimbării către partea reactivă, solubilitatea sulfatului de calciu ușor solubil este redusă în continuare (Erica Tran, 2016).
- Temperatura
Temperatura are un efect direct asupra solubilității. Pentru majoritatea substanțelor solide ionice, creșterea temperaturii crește viteza cu care se poate realiza soluția.
Pe măsură ce crește temperatura, particulele solidului se deplasează mai repede, ceea ce sporește șansele ca acestea să interacționeze cu mai multe particule ale solventului. Aceasta are ca rezultat creșterea vitezei cu care are loc o soluție.
Temperatura poate de asemenea să crească cantitatea de substanță dizolvată care poate fi dizolvată într-un solvent. În general, pe măsură ce crește temperatura, se dizolvă mai multe particule dizolvate.
De exemplu, atunci când zahărul de masă se adaugă în apă, este o metodă ușoară de a face o soluție. Atunci când soluția este încălzită și zahărul continuă să fie adăugat, se constată că pot fi adăugate cantități mari de zahăr, pe măsură ce temperatura continuă să crească.
Motivul pentru aceasta este că, pe măsură ce crește temperatura, forțele intermoleculare se pot descompune mai ușor, permițând atrăgării mai multor particule de substanță solubilă la particulele de solvent.
Există însă și alte exemple, în care creșterea temperaturii are un efect foarte redus asupra cantității de substanță dizolvată.
Sarea de masă este un bun exemplu: puteți dizolva aproape aceeași cantitate de sare de masă în apă cu gheață, după cum puteți în apă fiartă.
Pentru toate gazele, pe măsură ce crește temperatura, solubilitatea scade. Teoria moleculară cinetică poate fi folosită pentru a explica acest fenomen.
Pe măsură ce crește temperatura, moleculele de gaz se mișcă mai repede și pot scăpa din lichid. Apoi, solubilitatea gazului scade.

Privind următorul grafic, gazul de amoniac, NH3, prezintă o scădere puternică a solubilității cu creșterea temperaturii, în timp ce toate solidele ionice arată o creștere a solubilității pe măsură ce crește temperatura (CK-12 Foundation, SF) .
4- Presiune
Al doilea factor, presiunea, afectează solubilitatea unui gaz într-un lichid, dar niciodată un solid care se dizolvă într-un lichid.
Când se aplică presiune la un gaz care este deasupra suprafeței unui solvent, gazul se va deplasa în solvent și va ocupa unele dintre spațiile dintre particulele de solvent.
Un bun exemplu este sifonul carbonatat. Presiunea este aplicată pentru a forța moleculele de CO2 din sifon. Opusul este de asemenea adevărat. Când presiunea gazului scade, solubilitatea gazului respectiv scade.
Atunci când se deschide o cutie de băuturi carbogazoase, presiunea din sifon este coborâtă, astfel încât gazul să înceapă imediat să iasă din soluție.
Dioxidul de carbon stocat în sifon este eliberat și puteți vedea efervescența pe suprafața lichidului. Dacă lăsați o cutie deschisă de sifon pentru o perioadă de timp, puteți observa că băutura devine plată datorită pierderii dioxidului de carbon.
Acest factor de presiune a gazului este exprimat în legea lui Henry. Legea lui Henry afirmă că, la o anumită temperatură, solubilitatea unui gaz într-un lichid este proporțională cu presiunea parțială a gazului asupra lichidului.
Un exemplu al legii lui Henry apare în scufundări. Când o persoană se scufundă în apă adâncă, presiunea crește și se dizolvă mai multe gaze în sânge.
În timp ce se urcă dintr-o scufundare în apă adâncă, scafandrul trebuie să se întoarcă la suprafața apei la o viteză foarte lentă pentru a permite tuturor gazelor dizolvate să părăsească foarte încet sângele.
Dacă o persoană urcă prea repede, o urgență medicală poate apărea din cauza gazelor care părăsesc sângele prea repede (Papapodcasts, 2010).
5- Natura solutului
Natura solutului și a solventului și prezența altor compuși chimici în soluție afectează solubilitatea.
De exemplu, puteți dizolva o cantitate mai mare de zahăr în apă decât sarea în apă. În acest caz, se spune că zahărul este mai solubil.
Etanolul în apă este complet solubil unul cu celălalt. În acest caz particular, solventul va fi compusul care este în cantitate mai mare.
Dimensiunea solutului este, de asemenea, un factor important. Cu cât moleculele solubile sunt mai mari, cu atât sunt mai mari greutatea moleculară și dimensiunea lor. Este mult mai dificil pentru moleculele de solvenți să înconjoară molecule mai mari.
Dacă toți factorii menționați mai sus sunt excluși, se poate constata o regulă generală că particulele mai mari sunt, în general, mai puțin solubile.
Dacă presiunea și temperatura sunt aceleași ca și între două solute de aceeași polaritate, cea cu particule mai mici este de obicei mai solubilă (factori care afectează solubilitatea, SF).
6- Factori mecanici
Spre deosebire de viteza de dizolvare, care depinde în principal de temperatură, viteza de recristalizare depinde de concentrația de substanță dizolvată pe suprafața rețelei cristaline, care este favorizată atunci când o soluție este imobilă.
Prin urmare, agitarea soluției evită această acumulare, maximizând dizolvarea. (vârfuri de saturație, 2014).