chimie
Legile stoichiometriei descriu compoziția diferitelor substanțe, pe baza relațiilor (în masă) dintre fiecare specie care intervine în reacție. Toată materia existentă este formată din combinarea, în diferite proporții, a diferitelor elemente chimice care alcătuiesc tabelul periodic. Aceste uniuni sunt guvernate de anumite legi ale combinației cunoscute sub numele de "legile stoichiometriei" sau "legile de greutate ale chimiei". Aceste princ
Etanamida este o substanță chimică care aparține grupului de compuși organici de azot. De asemenea, acesta poartă numele de acetamidă, conform Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC pentru acronimul său în limba engleză). Comercial se numește amidă de acid acetic. Se numește amidă deoarece azotul este atașat la o grupare carbonil. Este primar, deoa
Reacția Maillard este numele dat reacțiilor chimice dintre aminoacizi și zaharurile reducătoare care ascund mâncarea în timpul prăjirii, coacere, prăjire și prăjire. Compușii bruni sunt formați responsabili pentru culoarea și aroma produselor cum ar fi crusta de pâine, carnea de vită friptă, cartofii prăjiți și biscuiții coapte. Reacția este favor
Clorura de aluminiu sau triclorura de aluminiu (AlCl3) este o sare binara formata din aluminiu si clor. Uneori apare ca o pulbere galbenă deoarece are impurități datorită prezenței clorurii de fier (III). Se obține prin combinarea elementelor sale. Aluminiu, care are trei electroni la ultimul nivel de energie (familia IIIA), tinde sa le cedeze datorita caracterului lor metalic. Clor
Acidul carboxilic este un termen care este atribuit oricărui compus organic care conține o grupare carboxil. Acestea pot fi denumite și acizi organici și sunt prezente în multe surse naturale. De exemplu, acidul formic, un acid carboxilic, este distilat din furnici și alte insecte, cum ar fi galerița gîndacilor. Adică,
Acidul alendronic este un compus organic care aparține clasificării bifosfonaților, în special celor de a doua generație; Acestea sunt cele care conțin atomi de azot. Acest compus, precum și restul de bifosfonați, are o analogie structurală ridicată cu pirofosfatul anorganic (PPi). Pirofosfatul anorganic este produsul multor reacții sintetice din organism. Este stoc
Acidul formic sau acidul metanoic Este cel mai simplu și mai mic compus din toți acizii organici. Este, de asemenea, cunoscut ca acid metanoic și formula moleculară este HCOOH, având doar un atom de hidrogen legat la atomul de carbon. Numele său provine din cuvântul " formica" , care în latină înseamnă ant. Naturalis
Acidul tartric este un compus organic al cărui formulă moleculară este COOH (CHOH) 2COOH. Are două grupări carboxil; adică, poate elibera doi protoni (H +). Cu alte cuvinte, este un acid diprotic. De asemenea, poate fi clasificat ca un acid alderic (zahăr acid) și un derivat de acid succinic. Sarea
Clorura de calciu (CaCl2 ) Este o sare anorganică compusă din calciu, metal alcalino-pământos și halogen clor. În acest compus există mai multe interacțiuni electrostatice care definesc aspectul exterior al cristalelor sale și restul proprietăților lor fizice. De asemenea, este întotdeauna însoțită de molecule de apă, formând hidrați de formule generale CaCl2 · xH2O, cu x = 0, 1, 2, 4 și 6. Când x = 0, sarea
Reacția exotermă este un tip de reacție chimică în care are loc un transfer de energie, în principal sub forma eliberării căldurii sau a luminii. Numele provine de la prefixul grecesc exo , ceea ce înseamnă "spre exterior"; și termenul "termic", care se referă la căldură sau la temperatură. În acest sens
Soluțiile chimice sunt așa-numitele amestecuri omogene în chimie. Sunt amestecuri stabile de două sau mai multe substanțe în care o substanță (numită substanță dizolvată) se dizolvă într-o altă substanță (numită solvent). Soluțiile adoptă faza solventului în amestec și pot exista în faze solide, lichide și gazoase. În natură există două
Piroliza constă într-un proces de descompunere termică în care substanțele - de origine organică, în marea sa majoritate - sunt supuse temperaturilor înalte într-un mediu inert (fără prezența oxigenului). Atunci când materia organică este tratată prin piroliză, se obțin produse care sunt utilizate în domeniul industrial. Unul dintre elem
Termochimia este responsabilă pentru studiul modificărilor calorice care se efectuează în reacțiile dintre două sau mai multe specii. Este considerată o parte esențială a termodinamicii, care studiază transformarea căldurii și a altor tipuri de energie pentru a înțelege direcția în care se dezvoltă procesele și modul în care variază energia lor. De asemenea, este
Azotatul de potasiu este o sare ternară compusă din potasiu, metal alcalin și azotat de oxoanion. Formula sa chimică este KNO 3 , ceea ce înseamnă că pentru fiecare ion K +, există un ion de NO 3 - care interacționează cu acesta. Prin urmare, este o sare ionică și constituie unul dintre nitrații alcalini (LiNO 3 , NaNO 3 , RbNO 3 ...). KNO 3 e
Difenilamină este un compus organic al cărui formulă chimică este (C6H5) 2NH. Numele ei indică faptul că este o amină, precum și formula sa (-NH2). Pe de altă parte, termenul "difenil" se referă la prezența a două inele aromatice legate de azot. Prin urmare, difenilamină este o amină aromatică. În lumea comp
Clorura de stronțiu este un compus anorganic format din stronțiu, metal alcalino-pământos (domnul Becamgbara) și clorul de halogen. Deoarece ambele elemente au electronegativități foarte diferite, compusul este un solid ionic a cărui formulă chimică este SrCl2. Deoarece este un solid ionic, este constituit din ioni. Pentru c
Fenolftalina este un colorant organic, care la rândul său este un acid diprotic slab, utilizat în numeroase determinări volumetrice ca indicator acid bază. Adică dacă este un acid diprotic, în soluție poate pierde două ioni de H + și pentru a fi un indicator trebuie să aibă proprietatea de a fi colorat în domeniul pH-ului care este evaluat. În mediu de
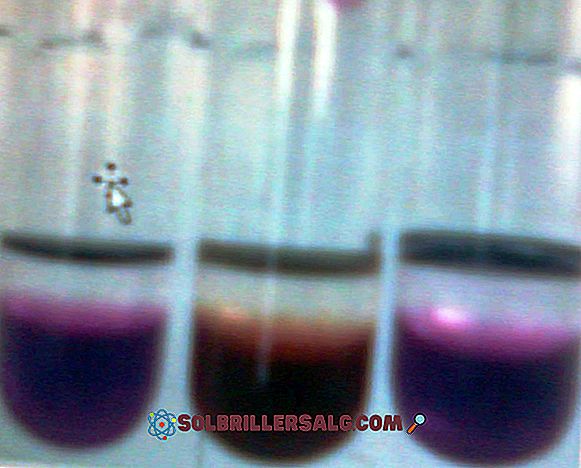
Permanganatul de potasiu (KMnO 4) este un compus anorganic format din mangan - grup de metale tranziționale 7 (VIIB) -, oxigen și potasiu. Este un solid închis și violet. Soluțiile lor apoase sunt de asemenea purpuriu închis; Aceste soluții devin mai puțin violete, deoarece sunt diluate în cantități mai mari de apă. Apoi, KMnO
Oxidul de stronțiu , a cărui formulă chimică este SrO (nu trebuie confundată cu peroxidul de stronțiu, care este SrO2), este produsul reacției oxidative dintre acest metal și oxigenul prezent în aer la temperatura camerei: 2Sr (s) + O2 (g) → 2SrO (s). O bucată de stronțiu arde în contact cu aerul ca o consecință a reactivității sale ridicate și având o configurație electronică a tipului ns2, dă randament cei doi electroni de valență, în special molecula diatomică de oxigen. Dacă suprafața metalului
Electronul diferențial sau diferențiat este ultimul electron plasat în secvența configurației electronice a unui atom. De ce este numele lui? Pentru a răspunde la această întrebare, structura de bază a unui atom este necesară: nucleul, vidul și electronii. Nucleul este un agregat dens, compact, de particule pozitive numite protoni, și de particule neutre numite neutroni. Protonii d
Hidroxiapatita este un mineral fosfat de calciu, a cărui formulă chimică este Ca 10 (PO 4 ) 6 (OH) 2 . Împreună cu alte minerale și materii organice rămâne zdrobit și compactat, el formează materia primă cunoscută sub numele de rocă fosforică. Termenul "hidroxi" se referă la anionul OH. Dacă în locul
Fosfatul de magneziu este un termen utilizat pentru a se referi la o familie de compuși anorganici formați din magneziu, metale alcalino-pământoase și oxoanionfosfat. Cel mai simplu fosfat de magneziu are formula chimică Mg3 (PO4) 2 . Formula indică faptul că pentru fiecare doi anioni PO 4 3- există trei cationi Mg2 + care interacționează cu aceștia. De asemene
Sticla Pyrex este o sticlă borosilicată specială a cărei marcă (Pyrex) a apărut în orașul New York în 1915, fabricată de Corning Glass. A apărut ca un material pentru ambalarea modernă a alimentelor, utilizat și pentru depozitarea și coacerea produselor alimentare în același tip de recipient. Originea cuvân
Enantiomerii sunt acele perechi de compuși organici (și anorganici) care constau din două imagini în oglindă care nu se pot suprapune una peste cealaltă. Când se întâmplă contrariul - de exemplu, în cazul unei mingi, al unui club de golf sau al unei furci - se spune că acestea sunt obiecte achirale. Termenul c
Metalele neferoase sunt toate cele care nu au sau au cantități neglijabile de fier. Acestea, în diferite proporții de masă, sunt utilizate pentru crearea de aliaje care prezintă proprietăți fizice mai bune decât metalele individuale. Astfel, structurile sale cristaline și interacțiunile metalice reprezintă piatra de temelie a aplicațiilor aliajelor neferoase. Cu toate ac
Precipitarea sau precipitarea chimică este un proces care constă în formarea unui solid insolubil din amestecul a două soluții omogene. Spre deosebire de precipitații de ploaie și zăpadă, în acest tip de precipitații "plouă solide" de pe suprafața lichidului. În două soluții omogene, ionii sunt dizolvați în apă. Atunci când acest
Caracterul metalic al elementelor din tabelul periodic se referă la toate acele variabile, chimice și fizice, care definesc metalele sau le disting de alte substanțe ale naturii. Ele sunt, în general, solide solide, dense, solide, cu conductivități termice și electrice ridicate, turnate și ductile. Cu toa
Sărurile de diazoniu sunt compuși organici în care există interacțiuni ionice între gruparea azo (-N2 +) și un anion X- (Cl-, F-, CH3COO-, etc.). Formula sa chimică generală este RN2 + X- și în acest caz, catena laterală R poate fi fie o grupare alifatică, fie o grupare arii; adică un inel aromatic. Structura io
Metalele feroase sunt cele care conțin fier (Fe), precum și cantități mici de alte metale care sunt adăugate pentru a da anumite proprietăți benefice aliajelor lor. Deși fierul poate exista în diferite stări de oxidare, cele mai frecvente sunt +2 (feroase) și +3 (ferice). Cu toate acestea, termenul "feros" se referă la prezența fierului indiferent de starea sa de oxidare în material. Fierul este
Teoria benzilor este cea care definește structura electronică a solidului ca întreg. Se poate aplica oricarui tip de solid, dar este in metalele unde se reflecta cele mai mari succese ale acestuia. Conform acestei teorii, legătura metalică rezultă din atracția electrostatică dintre ionii încărcați pozitiv și electronii mobili din cristal. Prin urmar